begin jaren tachtig van de vorige eeuw werd voor het eerst gewag gemaakt van een toename van infecties, vooral bij homoseksuele mannen, die gepaard gingen met een vermindering van de immuunrespons. snel werd duidelijk dat het hiv-virus aids veroorzaakt. sindsdien is het aantal aidspatiënten wereldwijd gegroeid. hoewel er al veel geneesmiddelen op de markt zijn die de symptomen bestrijden, blijft het wachten op een vaccin of middel dat de ziekte voorkomt of geneest.
De terreur van een ziekte
In de zomer van 1981 verschenen in de Mortality and Morbidity Weekly Report, uitgegeven door het US Center for Disease Control and Prevention, twee rapporten over de toename van infecties bij homoseksuele mannen in New York en Californië. Die infecties kwamen in het verleden zelden voor en men beklemtoonde dat artsen specifiek de aandacht moesten vestigen bij homoseksuele mannen op aandoeningen als het kaposisarcoom, pneumonie en andere opportunistische infecties die gepaard gaan met een vermindering van de immuunrespons. Sommigen namen aan dat dit een typische ‘homoziekte’ was, wat later werd weerlegd. Deze periode kan zonder meer worden beschouwd als de start van zeer intensief onderzoek naar de oorsprong van en een remedie tegen ‘aids’ of het ‘acquired immunodeficiency syndrome’. Een van de eerste resultaten uit dit onderzoek was het bewijs dat het agens dat aids veroorzaakt, kan worden overgedragen op andere mensen en dat de ziekte voornamelijk via seksuele contacten tussen homoseksuele mannen was verspreid. Zeer kort daarna zijn onderzoekers van het Pasteur Instituut in Parijs erin geslaagd, mede dankzij de vooruitgang in het domein van de retrovirologie, het aidsvirus te isoleren. Vandaag spreekt men eerder van het ‘hiv’-virus of het ‘human immunodeficiency virus’. Men moet een onderscheid maken tussen het hiv-1 en het zeldzamere hiv-2-virus, dat voornamelijk in West-Afrika voorkomt. Hoewel het relatief snel duidelijk was dat het hiv-virus aids veroorzaakt, bleven er nog steeds sceptici beweren dat dit niet zo was. Vele jaren later – in juli 2000 – volgde de verklaring van Durban, waarin vijfduizend wetenschappers van gerenommeerde instellingen over de hele wereld stellen dat volgens de geldende en algemeen aanvaarde wetenschappelijke inzichten het hiv-virus de oorzaak is van de ziekte aids.
Het voornaamste doelwit van het hiv-virus zijn de cellen van het immuunsysteem
Jarenlang onderzoek heeft stap voor stap aangetoond via welke verschillende wegen het virus het menselijke lichaam kan binnendringen. Het wordt van persoon tot persoon overgedragen voornamelijk via bloed, zaad en vaginale secreties. Het voornaamste doelwit van het hiv-virus zijn de cellen van het immuunsysteem. De belangrijkste functie van die cellen is het onschadelijk maken van lichaamsvreemde stoffen en organismen en het hiv-virus zal juist dit systeem aanvallen. Nadat het virus een cel van het immuunsysteem is binnengeraakt, begint het aan een onophoudelijk proces van replicatie, waardoor op termijn het lichaam bevolkt wordt door een grote populatie virussen. Dit proces leidt uiteindelijk tot verregaande aantasting van het immuunsysteem.
Alvorens dieper op de anti-hiv-therapiemogelijkheden in te gaan, is het nuttig om dit replicatieproces van het hiv-virus te bekijken. Dit zal ons toelaten te begrijpen hoe verschillende klassen van de hedendaagse anti-hiv-geneesmiddelen werken. Virussen zijn in zekere zin niet-levende wezens: ze zijn een soort ‘brein zonder lichaam’. Om nieuwe virussen aan te maken moeten ze een vreemde cel kapen die ze gebruiken om zich te vermenigvuldigen. Het hiv-virus begint zijn infectie door te binden aan de CD4-receptor, die gelegen is op het oppervlak van vele cellen. Men heeft echter aangetoond dat bij dit proces eveneens een coreceptor betrokken is. Het belangrijkste doelwit zijn de T4-lymfocyten (een witte bloedcel die ook wel eens T-helpercel wordt genoemd). Wanneer het hiv-virus bindt met de gastheercellen, worden er bepaalde proteïnen op het celoppervlak geactiveerd waardoor het omhulsel van het virus (de ‘enveloppe’) kan versmelten (‘fusion’) met de gastheercel. Het hiv-virus bezit geen DNA (desoxyribonucleïnezuur) zoals de mens, maar heeft de erfelijke informatie opgeslagen in twee RNA-ketens (ribonucleïnezuurketens). Opdat het virus een gastheercel kan infecteren, is het noodzakelijk dat het virale materiaal kan worden gekopieerd in de gastheercel. Nadat het virus de cel is binnengedrongen, zal een viraal enzyme, reverse transcriptase, een DNA-kopie maken van het virale RNA. De term reverse transcriptase wordt gebruikt omdat de normale weg de vorming van RNA uit DNA is, en niet omgekeerd zoals bij het hiv-virus. Het nieuwe, uit RNA gevormde DNA wordt het provirale DNA genoemd. Dit DNA wordt naar de celkern van de gastheercel gebracht waar het door toedoen van een ander viraal enzyme, integrase genaamd, in het DNA van de gastheercel wordt geïncorporeerd. Het virale DNA kan hier jaren verblijven in een latente toestand en dit vormt een van de grootste barrières om het hiv-virus volledig uit te roeien. Dit is ook de reden waarom hiv-patiënten levenslang anti-hiv-therapie moeten krijgen. Op een bepaald moment zal dit virale DNA worden vertaald naar boodschapper RNA (messenger RNA), dat vervolgens buiten de celkern zal worden vertaald naar verschillende virale proteïnen. Het nieuw gevormde RNA bevat opnieuw het genetische materiaal van de volgende generatie virussen. Het virale RNA en de virale proteïnen worden dan geassembleerd tot een nieuw virus. Eén van die virale proteïnen is het enzyme protease dat noodzakelijk is om andere proteïnen om te zetten naar een functionele vorm (enzyme, structurele elementen, …). Eens het virus geassembleerd is, kan het uit de gastheercel worden vrijgezet en weer andere cellen gaan infecteren. Dit leidt tot de vernietiging van het immuunsysteem van de gastheer.
Virussen zijn in zekere zin niet-levende wezens: ze zijn een soort ‘brein zonder lichaam’
Het begrijpen van het replicatieproces heeft geleid tot de ontwikkeling van verschillende klassen van anti-hiv-geneesmiddelen die elk een specifiek aangrijpingspunt in de replicatiecyclus hebben. De entry– of fusion-blokkers verhinderen de samensmelting van de virale enveloppe met de gastheercel. De reverse transcriptase-inhibitoren verhinderen de omzetting van viraal RNA tot viraal DNA. De integrase-inhibitoren blokkeren de inbouw van viraal DNA in dat van de gastheercel. De protease– en maturatie-inhibitoren blokkeren de assemblage van het virus. Een heel aantal hiv-geneesmiddelen zijn reeds op de markt, andere zitten nog in een klinische onderzoeksfase. In 1986 keurde de Amerikaanse Food and Drug Administration (FDA) het geneesmiddel zidovudine (AZT) goed voor gebruik in de preventie van hiv-replicatie. AZT is een nucleoside reverse transcriptase-inhibitor (NRTI). Na 1991 werden verschillende andere nucleoside-analogen toegevoegd aan het anti-hiv-arsenaal, alsook nieuwe klassen zoals de non-nucleoside reverse transcriptase-inhibitoren (NNRTI), de protease-inhibitoren (PI), integrase-inhibitoren (II) en fusie-inhibitoren (FI). Ondanks een ware proliferatie van geneesmiddelen bleef de standaard antivirale therapie tot het midden van de jaren negentig van de vorige eeuw een monotherapie, of een therapie die beperkt bleef tot één geneesmiddel. En hoewel die geneesmiddelen toch deels efficiënt bleken, was er een grote variatie in doeltreffendheid tussen individuen.
Gedurende die periode werd ook een grote stap voorwaarts gezet in het beter begrijpen hoe het virus functioneert in het lichaam. Daar waar men eerder dacht dat individuen in een latente periode terechtkwamen na een eerste infectie, werd het duidelijk dat replicatie nog steeds voortduurde zelfs als het geïnfecteerde individu geen ziekteverschijnselen vertoonde. Die kennis heeft zeker ook geholpen in het verstaan van het waarom en hoe het virus geleidelijk aan minder gevoelig wordt voor bepaalde antivirale middelen, een proces dat we resistentie noemen. Resistentie tegen antivirale middelen is een ernstige bedreiging omdat die geneesmiddelen minder efficiënt of zelfs totaal onwerkzaam worden. (Dit probleem stelt zich overigens ook bij het antibioticagebruik.) Bovendien, wanneer een organisme resistent wordt tegen een geneesmiddel, bestaat de kans dat dit organisme ook resistentie vertoont tegen andere geneesmiddelen uit dezelfde klasse (cross resistance) of voor geneesmiddelen uit andere klassen (multidrug resistance). Men zag dan ook in dat monotherapie van weinig nut zou zijn in de bestrijding van het hiv-virus op langere termijn. De uitbreiding van het aantal klassen van antivirale geneesmiddelen maakte het echter wel mogelijk om te veranderen van monotherapie naar een combinatietherapie waarbij geneesmiddelen van verschillende klassen tegelijkertijd worden gebruikt. (Men duidt dit ook vaak aan als antivirale cocktails.) Die aanpak heeft geleid tot een zeer efficiënte therapie. Zo zal bijvoorbeeld bij combinatie van didanosine (NRTI) met stavudine (NRTI) en indinavir (PI), een virusstam die resistent is aan didanosine, onder controle worden gehouden door stavudine en indinavir, terwijl een indinavir resistente stam onder controle wordt gehouden door didanosine en stavudine. Als men NRTI’s, NNRTI’s, PI’s, fusie-inhibitoren of integrase-inhibitoren combineert, spreekt men van HAART (highly active antiretroviral therapy). HAART heeft geleid tot significante verbetering van de algemene gezondheidstoestand van patiënten en heeft de kans op resistentieontwikkeling tot een minimum beperkt. Sinds 1997 is combinatietherapie de standaardbehandeling geworden.
Resistentie tegen antivirale middelen is een ernstige bedreiging omdat die geneesmiddelen minder efficiënt of zelfs totaal onwerkzaam worden
Naast de behandeling met ‘klassieke’ antivirale geneesmiddelen wordt er reeds geruime tijd intensief onderzoek verricht om een vaccin te kunnen ontwikkelen. Een vaccin is een substantie die de immuunrespons van het lichaam stimuleert met als doel een infectie te voorkomen of onder controle te houden. Er zijn verschillende types van vaccins en deze die onderzocht worden in het kader van hiv-bestrijding zijn subunit-vaccins, recombinante vector-vaccins en DNA-vaccins. Die vaccins bevatten alle een deel van het hiv-virus, maar ze kunnen geen infectie of aids veroorzaken. Subunit-vaccins (component vaccins) bevatten individuele proteïnen of peptiden van het virus die worden aangemaakt via genetische manipulatie. De meeste zijn gebaseerd op hiv-enveloppeproteïnen. Het virus like particle vaccin (VLP of pseudovirion vaccin) is een ander type subunit-vaccin. Recombinant vector vaccins zijn gebaseerd op micro-organismen (virussen, bacteriën) die zelf geen ziekte kunnen veroorzaken. Ze worden gebruikt als een vervoermiddel (vector) om hiv-genen in cellen te kunnen brengen. Het lichaam maakt hieruit proteïnen die een anti-hiv-immuunrespons stimuleren. In tegenstelling hiermee bevatten DNA-vaccins naakt DNA dat wordt ingespoten. Als cellen dit DNA opnemen, worden er hiv-proteïnen aangemaakt waartegen een immuunrespons kan worden ontwikkeld. Ook in geval van vaccins kan men een combinatietherapie gebruiken. Die is gekend als prime-boost strategy en is erop gericht twee verschillende types vaccin consecutief toe te dienen om zo verschillende immuunresponsen te stimuleren. Ondanks het feit dat vrij intensief onderzoek wordt verricht, zal het nog geruime tijd duren voor een vaccin commercieel beschikbaar zal zijn tegen hiv/aids. Momenteel zijn er over de hele wereld meer dan dertig vaccins die in de testfase zitten.
Op dit moment zijn er nog geen geneesmiddelen om aids daadwerkelijk te genezen en het virus volledig uit het lichaam te verwijderen. De wetenschap boekt echter steeds vooruitgang en de laatste jaren is een groot aantal middelen die de vermenigvuldiging van het virus afremmen, commercieel beschikbaar geworden. Behandeling met die middelen maakt dat seropositieve mensen langer in leven blijven en dat de levensverwachting van aidspatiënten toeneemt. Het blijft echter wachten op een vaccin of een geneesmiddel dat bescherming biedt tegen de infectie of de infectie kan genezen.
A. Sasse & A. Defraye, HIV/AIDS in België. Semestrieel rapport Nr. 64. Toestand op 31 december 2006 (Wetenschappelijk Instituut Volksgezondheid & College van de AIDS-Referentielaboratoria mei 2007).
Figuur 1
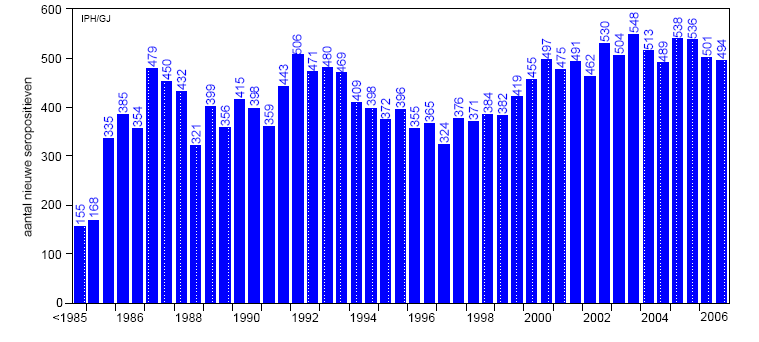
Evoluties van het aantal nieuwe hiv-diagnoses per semester
Bron: A. Sasse & A. Defraye
Figuur 2
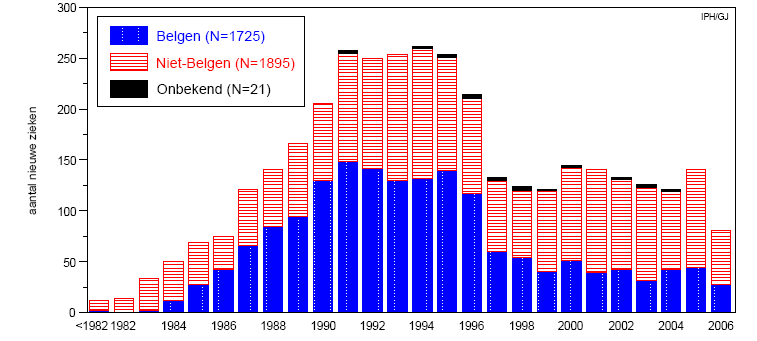
Nieuwe aidspatiënten per jaarlijkse aangifte en volgens nationaliteit
Bron: A. Sasse & A. Defraye
Guy van den Mooter is als farmaceutisch technoloog verbonden aan de KU Leuven.

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivs 3.0 Unported License

