zowel in ons eigen lichaam als in onze dagelijkse interacties met gebruiksvoorwerpen en producten worden voortdurend atoomverbindingen gevormd en verbroken. dat gaat niet altijd vanzelf: sommige chemische veranderingen zijn in principe alleen mogelijk onder heel specifieke omstandigheden, bijvoorbeeld erg hoge druk en/of temperatuur. er bestaan echter producten, katalysatoren genaamd, die de herschikking van atomen een pak vlotter laten verlopen. tot zo’n twintig jaar geleden lag de nadruk vooral op metaalgebaseerde katalysatoren, maar tegenwoordig worden er steeds meer metaalvrije alternatieven ontwikkeld. hun ontdekking heeft geleid tot een nieuw onderzoeksdomein, de organokatalyse, waarvoor benjamin list en david macmillan vorig jaar de nobelprijs chemie ontvingen.
Moleculen, maar dan makkelijk: de Nobelprijs Chemie 2021
Chemische reacties zijn de drijvende kracht achter bijna alle aspecten van ons leven. Alles om ons heen bestaat uit atomen, met elkaar verbonden tot moleculen door chemische verbindingen. In ons lichaam worden die verbindingen voortdurend gemaakt en weer verbroken in een breed scala aan levensbelangrijke biochemische processen. Daarbij gaat het onder andere over het vormen en doen functioneren van de meest fundamentele bouwstenen van het leven: eiwitten, koolhydraten, vetten en dna. Ook de productie van heel wat industriële producten die we dagelijks gebruiken, zoals medicijnen, plastics, parfums en smaakstoffen, steunt op chemische transformaties.
In de meeste gevallen gebeurt dat vormen en verbreken van verbindingen om nieuwe moleculaire structuren te vormen echter niet vanzelf. Als er niet genoeg energie ter beschikking is, bijvoorbeeld in de vorm van verhitting, zal de ordening van atomen binnen moleculen doorgaans niet veranderen. Gelukkig bestaan er chemische producten die het vereiste energieniveau bij chemische reacties kunnen veranderen, waardoor de atomen toch herschikt kunnen worden en nieuwe moleculen kunnen vormen. Deze chemische producten worden katalysatoren genoemd. Bepaalde chemische veranderingen, die normaal heel traag gaan tenzij de temperatuur en/of druk heel hoog is, kunnen door de aanwezigheid van een katalysator snel en vlot plaatsvinden in gemakkelijkere en veiligere omstandigheden. Doordat de katalysator zelf intact blijft, kan die meerdere keren hergebruikt worden voor hetzelfde herschikkingsproces. Dankzij het gebruik van katalysatoren worden er dus veel meer chemische transformaties mogelijk waarvoor de temperatuur of druk niet buitensporig hoog moet zijn en de reactietijd niet overdreven lang.
Levende organismen bezitten een leger van duizenden natuurlijke katalysatoren
Dat grote belang van katalysatoren in de vorming van nieuwe moleculen maakt ze alomtegenwoordig in veel chemische domeinen. Levende organismen bezitten een leger van duizenden natuurlijke katalysatoren in de vorm van enzymen: grote, complexe biomoleculen die specifiek interageren met andere biomoleculen om (bio)chemische veranderingen teweeg te brengen. Enzymen worden eveneens in heel wat belangrijke industriële processen gebruikt. Een voorbeeld is penicilline G amidase, een enzym waarmee tonnen antibiotica worden geproduceerd, amoxicilline bijvoorbeeld, om allerlei bacteriële infecties te bestrijden.
Chemici hebben door de jaren heen ook diverse synthetische katalysatoren ontwikkeld, die even diverse reacties faciliteren. Ammoniak (NH3), essentieel voor meststoffen, kan gemaakt worden uit H2 en N2, maar het ontstaat niet spontaan wanneer die gassen gemengd worden: stikstof – waar onze atmosfeer voor 78 % uit bestaat – is heel weinig reactief. Wanneer er echter ijzer wordt toegevoegd, dan gaat de reactie van H2 en N2 tot NH3 een stuk vlotter: de interactie van de H2– en N2-moleculen met het oppervlak van de metalen katalysator maakt ze reactiever. Dit noemen we het Haberproces, genoemd naar de Duitse scheikundige Fritz Haber, die er in 1918 de Nobelprijs Chemie voor kreeg. Ook de driewegkatalysatoren in auto-uitlaten bevatten metalen, zoals platina, die de giftige gassen die vrijkomen bij verbranding van brandstof – koolstofmonoxide (CO), stikstofoxide (NO) en stikstofdioxide (NO2) – omzetten in minder schadelijke gassen zoals koolstofdioxide (CO2), stoom (H2O) en stikstofgas (N2). Katalysatoren werken heel goed, maar niet voor alle soorten reacties. Het blijft dus een uitdaging om efficiënte, toegankelijke katalysatoren te ontwikkelen voor specifieke chemische processen.
Tot de laatste eeuwwisseling domineerden metaalgebaseerde katalysatoren het domein van de chemische synthese, dat zich bezighoudt met de vorming van nieuwe, complexere moleculen uit eenvoudigere via chemische reacties. Scheikundigen zijn al lang gefascineerd door metalen, wat niet hoeft te verbazen: de meeste elementen in het periodiek systeem zijn metalen. Ze zijn ook vaak ideale katalysatoren doordat ze zo welwillend elektronen afgeven en aannemen. Elektronen houden de chemische verbindingen in moleculen bij elkaar, dus wanneer zij aan het bewegen gaan (bijvoorbeeld onder invloed van metalen) kunnen verbindingen verbroken en nieuwe verbindingen gevormd worden.
Metalen zijn ideale katalysatoren omdat ze zo welwillend elektronen afgeven en aannemen
De laatste jaren worden er echter steeds meer eenvoudige metaalvrije moleculen ontwikkeld als katalysatoren, en dat heeft een revolutie veroorzaakt in hoe we chemische reacties uitvoeren. Net als de enzymen in ons lichaam bestaat deze nieuwe familie katalysatoren uit moleculen die vooral gebouwd zijn uit koolstof, waterstof, zuurstof en stikstof. Omdat ze uit dezelfde elementen bestaan als organisch materiaal worden ze dan ook organokatalysatoren genoemd. Ze zijn wel een stuk kleiner, robuuster en makkelijker te produceren dan enzymen, en vaak minder toxisch, veiliger, goedkoper, milieuvriendelijker en stabieler dan metaalkatalysatoren. Hun ontdekking heeft dan ook geleid tot een nieuw onderzoeksdomein, de organokatalyse, waarvoor Benjamin List (directeur van het Max Planck Instituut voor Kolenonderzoek en erehoogleraar aan de Universiteit van Keulen) en David MacMillan (hoogleraar aan Princeton, VS) vorig jaar de Nobelprijs Chemie ontvingen.
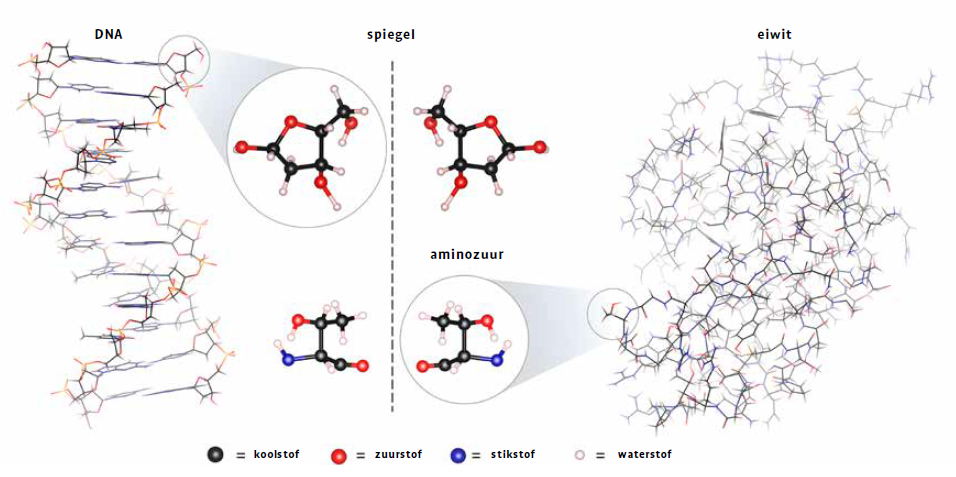
Specifieker kregen List en MacMillan die prijs voor de ontwikkeling van asymmetrische organokatalyse. Ze vestigden niet enkel een nieuw type metaalvrije katalysatoren, maar toonden ook aan dat die selectief gebruikt kunnen worden om slechts één type moleculaire structuur te vormen in plaats van gelijkaardige alternatieven. Dit type selectiviteit staat betekend als asymmetrische katalyse en is een van de grootste uitdagingen in de chemie, aangezien eenzelfde atoomsamenstelling vaak leidt tot moleculen die elkaars spiegelbeeld zijn, enantiomeren genoemd. Net als een paar schoenen of handschoenen zijn die moleculen structureel bijna identiek, maar toch niet exact hetzelfde, door de relatieve positie van hun atomen.
Net als een paar handschoenen zijn enantiomeren structureel bijna identiek, maar toch niet helemaal
Zoals een handschoen ook alleen echt goed zit aan de juiste hand, kunnen de verschillen tussen enantiomeren een grote impact hebben op de fysische en chemische eigenschappen van de moleculen in kwestie, zeker in biologische processen. Veel biomoleculen, zoals de suikers en aminozuren die respectievelijk dna en eiwitten vormen, kunnen spiegelbeeldstructuren hebben, maar zijn doorgaans slechts in één van beide vormen aanwezig in organismen. Wanneer we geneesmiddelen maken, is het dan ook erg belangrijk om slechts één van de gespiegelde beelden van de medicijnmolecule te vormen: meestal staat alleen die kant in voor de gewenste therapeutische activiteit en is de andere in het beste geval inactief, in het slechtste geval schadelijk. Dat laatste is helaas het geval voor thalidomide, een mengeling van twee gespiegelde moleculen, in België ooit verkocht onder de bekende naam Softenon. In de jaren 1950 en 1960 werd het in Europa gebruikt om misselijkheid bij zwangere vrouwen te behandelen, tot werd ontdekt dat het verantwoordelijk was voor misvormingen bij duizenden baby’s, en zelfs talloze dodelijke slachtoffertjes. Men gaat ervan uit dat dit schadelijke effect te wijten is aan één van beide spiegelvormen van het medicijn, terwijl de andere vorm wel het gewenste effect had.
Gelukkig is het dankzij asymmetrische katalysatoren nu dus mogelijk om de voorkeur te geven aan de vorming van één van de spiegelbeelden van een molecule. Zulke katalysatoren zijn dus essentieel wanneer we extreem zuivere moleculen nodig hebben met een heel specifieke configuratie, zoals vaak het geval is in biomedische toepassingen. Het concept asymmetrische katalyse is dan ook zo belangrijk dat William S. Knowles, Ryoji Noyori en Barry Sharpless al in 2001 de Nobelprijs Chemie kregen voor hun werk errond.
De Nobelprijs die vorig jaar werd uitgereikt is eigenlijk de laatste in een reeks van zeven Nobelprijzen Chemie die allemaal iets te maken hebben met katalyse. De eerste ging in 1909 naar Wilhelm Ostwald voor zijn werk rond de fundamentele aspecten van katalyse, en elke Nobelprijs daarna is toegekend aan een ware mijlpaal in de evolutie van dit belangrijke en constant groeiende onderzoeksveld. De prijs van 2021 beweegt echter duidelijk weg van de metaalgebaseerde katalysatoren die zo belangrijk waren voor de voorgaande doorbraken. De organokatalyse opent dan ook een hele nieuwe wereld aan mogelijkheden. Sinds de eerste onafhankelijke publicaties door List en MacMillan in het jaar 2000, waarin het potentieel van kleine organische moleculen voor de katalyse van allerlei chemische transformaties duidelijk werd, zijn er al heel wat nieuwe organokatalysatoren ontdekt.
Sinds 1909 werden al zeven Nobelprijzen toegekend die iets te maken hebben met katalyse
Eén belangrijk element in die nieuwe ontdekkingen is de identificatie van ‘generische activatiemodi’. Erg veel verschillende moleculen kunnen gebruikt worden als organokatalysator, maar niet allemaal bij hetzelfde type reacties. Organokatalysatoren die qua structuur genoeg op elkaar lijken kunnen echter wel voor dezelfde reacties gebruikt worden, want ze maken andere moleculen op een vergelijkbare manier reactiever, een manier die we de activatiemodus noemen. Zo konden organokatalysatorenfamilies ontwikkeld worden met dezelfde sleutelcomponenten in hun structuur, maar met kleine verschillen in hun efficiëntie als katalysatoren. Ook naar andere families wordt nog gezocht, zodat de mogelijke toepassingen van organokatalyse steeds verder uitgebreid kunnen worden. Dankzij de basis die List en MacMillan legden, is het onderzoek naar organokatalyse de laatste twintig jaar dan ook exponentieel gegroeid.
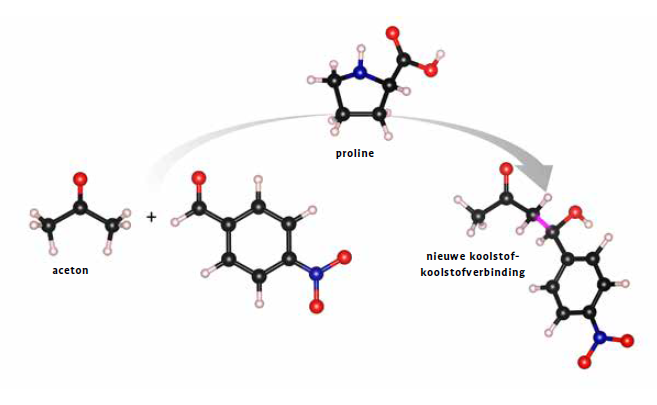
Wat het werk van List en MacMillan zo onderscheidt van eerder onderzoek naar organokatalysatoren, waarbij het vooral ging om één type chemische transformatie, is precies de ontwikkeling van een algemeen organokatalyseprincipe voor een breed gamma aan reacties, door middel van eenvoudige organische moleculen. Hoewel ze tot gelijkaardige conclusies kwamen, werkten List en MacMillan trouwens onafhankelijk van elkaar en haalden ze hun inspiratie in verschillende hoeken. Zijn ervaring met het ontwikkelen van antilichamen als biologische katalysatoren riep bij Benjamin List de vraag op of katalyseactiviteit wel een groot, complex eiwit bestaand uit meerdere aminozuren vereist, of dat één aminozuur ook genoeg kan zijn om een reactie te faciliteren. Hij ontdekte dat het aminozuur proline geschikt was als katalysator om één voorkeursspiegelvorm voort te brengen. Dat bewees hij voor een reactie waarin koolstof-koolstofverbindingen werd gevormd, de basis voor alle organische moleculen en dus uiterst belangrijk.
List en MacMillan haalden hun inspiratie in verschillende hoeken
Parallel daarmee vroeg David MacMillan zich bij zijn onderzoek naar metaalgebaseerde katalysatoren af of het mogelijk zou zijn om kleine organische moleculen te ontwerpen die elektronen net zo kunnen helpen bewegen als metalen. Hij toonde aan dat je met moleculen die lijken op proline een reactie kunt katalyseren (een andere dan die van List) waarbij koolstof-koolstofverbindingen worden gevormd. De publicatie die hieruit voortvloeide was de eerste die de term ‘organokatalyse’ gebruikte als overkoepelende term voor dit soort katalyse, en zo werd de basis gelegd voor het werk dat snel zou volgen.
Sinds hun eerste ontdekkingen hebben List en MacMillan het groeiende onderzoeksdomein organokatalyse verder ontwikkeld, samen met talrijke andere onderzoekers overal ter wereld. De laatste jaren ligt de klemtoon op het verkennen van nieuwe types chemische reactiviteit. Een erg interessante benadering is de combinatie van organo- en fotokatalyse. Dat laatste is een vorm van katalyse die reacties faciliteert aan de hand van licht in plaats van de gewoonlijke, minder duurzame energiebron, warmte. De combinatie van foto- met asymmetrische organokatalyse is extra spannend omdat ze selectieve vorming van het voorkeursspiegelproduct toelaat, wat doorgaans niet eenvoudig is met fotokatalyse die gebruikmaakt van metaalkatalysatoren. Onlangs is ook aangetoond dat organokatalysatoren gebruikt kunnen worden in cascadereacties, waarbij meerdere chemische transformaties op rij worden uitgevoerd zonder dat we het product van elke reactie moeten scheiden en zuiveren om verder te kunnen.
Een uiterst interessante demonstratie van het nut van organokatalysatoren in cascadereacties is de synthese vanaf nul van de structureel erg complexe molecule strychnine, een giftige stof die vaak gebruikt wordt als rattenvergif en ook dient als ijkpunt bij het testen van synthetische strategieën. Dit soort cascadereacties maakt het productieproces van nieuwe moleculen efficiënter en sneller. Hoewel ons lichaam vaak zulke cascadereacties gebruikt om nieuwe moleculen te vormen, is het echter nog een grote uitdaging om ze in het lab te doen slagen. Organokatalyse opent dus deuren naar heel wat nieuwe mogelijkheden, zoals het uitvoeren van selectievere fotokatalytische en efficiëntere cascadereacties. Zo draagt organokatalyse ook bij tot oplossingen voor veelvoorkomende problemen in de chemie.
Ondanks het grote potentieel is organokatalyse nog niet helemaal ingeburgerd in de chemische industrie
De Nobelprijs Chemie erkent de grote successen die de laatste jaren behaald zijn dankzij asymmetrische organokatalyse. Ondanks het grote potentieel ervan is organokatalyse echter nog niet helemaal ingeburgerd in de chemische industrie. Om daarvoor te zorgen moeten organokatalysatoren wellicht nog efficiënter worden en moeten ze nog gemakkelijker te hergebruiken zijn in verschillende reactiecycli.
Toch ziet het ernaar uit dat de principes van organokatalyse steeds vaker ingang zullen vinden in industriële toepassingen dankzij de hogere stabiliteit, lagere toxiciteit en beperktere kost van organische ten opzichte van metaalgebaseerde katalysatoren. Organokatalysatoren zijn bijvoorbeeld al in gebruik genomen voor de vorming van moleculen die verantwoordelijk zijn voor bepaalde parfumgeuren. Ze zijn ook veelbelovend voor de productie van allerlei geneesmiddelen, waaronder darunavir voor de behandeling van hiv, paroxetine als middel tegen angst en depressie, en oseltamivir tegen luchtweginfecties. Zeker in dat laatste geval zijn er duidelijke voordelen: de typische methode om oseltamivir industrieel te synthetiseren telt twaalf stappen, met organokatalyse kan dit worden teruggebracht tot slechts vijf. En zoals Benjamin List zei bij het ontvangen van de Nobelprijs: ‘de uitdagingen waar de mensheid op dit moment voorstaat – opwarming van de aarde, energieomzetting en zo verder – zullen aangepakt moeten worden met behulp van katalyse’. Dat zal de komende jaren hoogstwaarschijnlijk leiden tot nog meer Nobelprijzen in de Chemie voor katalysegerelateerde ontdekkingen, en die doorbraken zullen gebouwd zijn op de basis gelegd door de ontdekking van asymmetrische organokatalyse.
David Salazar Marcano is doctoraatsonderzoeker in het Labo voor Bioanorganische Chemie aan de KU Leuven. Zijn onderzoeksinteresses liggen op het snijvlak tussen anorganische en biochemie. Hij ontwikkelt op dit moment nieuwe biomaterialen op basis van eiwitten en metaal-zuurstofnanoclusters en onderzoekt de reactiviteit van die nanoclusters op eiwitten.
Tatjana Parac-Vogt is hoogleraar en hoofd van het Labo voor Bioanorganische Chemie aan de KU Leuven, waar ze interdisciplinair onderzoek voert naar de interactie tussen anorganische chemie, biochemie, materiaalkunde en katalyse. Ze is lid van AcademiaNet, een wereldwijd portaal met excellente vrouwelijke wetenschappers, en de stichter van de Vlaamse tak. Op dit moment is ze vicevoorzitter van de European Rare-Earth and Actinide Society.

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivs 3.0 Unported License

